¿Cuándo recibiremos una vacuna?
Esta es la mayor pregunta que está en la mente de todos hoy en día. Una vacuna, después de todo, es nuestra mayor esperanza para evitar que el nuevo coronavirus se propague por todas partes. El primer paso importante hacia esto se ha dado con el primer ensayo humano para evaluar una vacuna candidata contra el nuevo coronavirus que ha comenzado en los Estados Unidos.

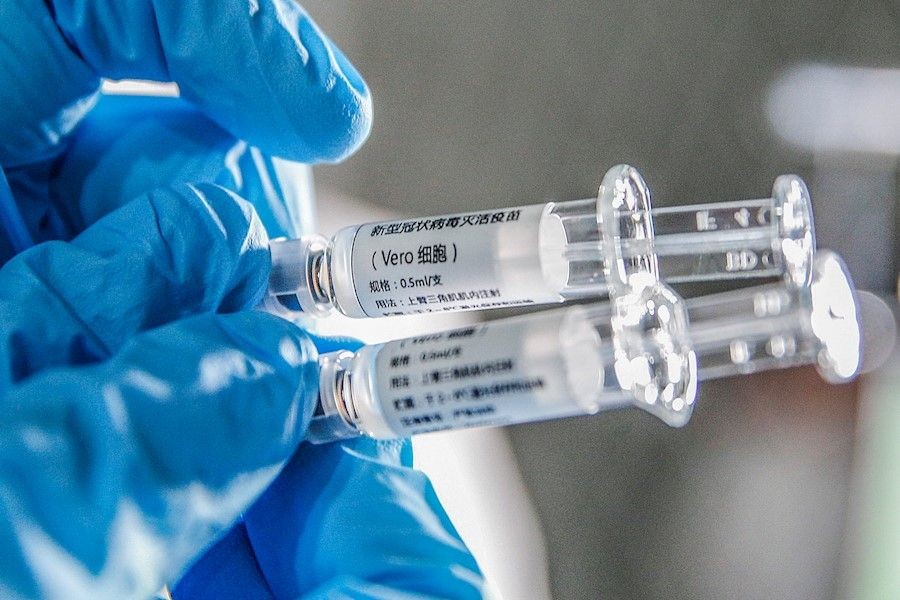
La vacuna, llamada mRNA-1273, fue desarrollada por científicos y colaboradores de los Institutos Nacionales de Salud de Estados Unidos (NIH) de la empresa de biotecnología Moderna. "El ensayo de etiqueta abierta inscribirá a 45 voluntarios adultos sanos de 18 a 55 años durante aproximadamente 6 semanas", dijo el NIH.
El primer participante ya ha recibido la vacuna en investigación. Sin embargo, una vacuna disponible comercialmente todavía podría estar disponible entre 12 y 18 meses de distancia.
El ensayo estudiará el impacto de las diferentes dosis administradas por inyección intramuscular en la parte superior del brazo. Se controlará a los participantes para ver si hay efectos secundarios como el afán o la fiebre. Es importante tener en cuenta aquí que los coronavirus tienen forma esférica y tienen picos que sobresalen de su superficie. Los picos del virus se unen a las células humanas y, por lo tanto, permite su entrada en el cuerpo.
La vacuna candidata moderna contiene la información genética de este pico en una sustancia que se llama "ARN mensajero". Por lo tanto, causa una respuesta inmune sin haber infectado realmente a una persona con el virus en toda regla. Mucho depende de esta vacuna y su éxito será perjudicial para la forma en que licitemos a la pandemia del coronavirus.
Cronología.
El 11 de enero de 2020, las autoridades chinas compartieron la secuencia genética del nuevo coronavirus.
El 13 de enero de 2020, los Institutos Nacionales de Salud de los EE. UU. (NIH) y el equipo de investigación de enfermedades infecciosas de Moderna finalizaron la secuencia del ARNm-1273, la vacuna de la Compañía contra el nuevo coronavirus. En ese momento, el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) , parte de los NIH, reveló su intención de realizar un estudio de Fase 1 utilizando la vacuna mRNA-1273 en respuesta a la amenaza del coronavirus y Moderna se movilizó hacia la fabricación clínica. La fabricación de este lote fue financiada por la Coalition for Epidemic Preparedness Innovations (CEPI).
El 7 de febrero de 2020, se completó el primer lote clínico, incluido el llenado y el acabado de los viales, un total de 25 días desde la selección de la secuencia hasta la fabricación de la vacuna. El lote luego pasó a las pruebas analíticas para su liberación.
El 24 de febrero de 2020, el lote clínico fue enviado desde Moderna al NIH para su uso en su estudio clínico de Fase 1.
El 4 de marzo de 2020, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) completó su revisión de la solicitud de Investigación de Nuevos Medicamentos (IND) presentada por el NIH para mRNA-1273 y permitió que el estudio procediera a comenzar los ensayos clínicos.
El 16 de marzo de 2020, el NIH anunció que el primer participante en su estudio de Fase 1 para mRNA-1273 fue dosificado, un total de 63 días desde la selección de secuencia hasta la primera dosificación en humanos. Este estudio de Fase 1 proporcionará datos importantes sobre la seguridad e inmunogenicidad del ARNm-1273. La inmunogenicidad significa la capacidad de la vacuna para inducir una respuesta inmune en los participantes. Se espera que el ensayo abierto inscriba a 45 voluntarios adultos sanos de entre 18 y 55 años durante aproximadamente seis semanas.
El 23 de marzo de 2020, Moderna presentó un Informe Actual en el Formulario 8-Kque incluía, entre otras cosas, información sobre el momento potencial de la disponibilidad de una vacuna contra COVID-19.
La Compañía informó que el estudio de Fase 1 se está llevando a cabo de acuerdo con el protocolo bajo la dirección del NIAID.
La compañía informó además que, si bien es probable que una vacuna disponible comercialmente no esté disponible durante al menos 12-18 meses, es posible que, en caso de emergencia, una vacuna esté disponible para algunas personas, posiblemente incluyendo profesionales de la salud, en el otoño de 2020.
Cualquier uso de emergencia estaría sujeto a la autorización de las agencias reguladoras correspondientes, con base en la aparición de datos clínicos para mRNA-1273 que respaldarían el uso de la vacuna antes de la licencia.
Adicionalmente, La Compañía confirmó que está aumentando la capacidad de fabricación para la producción de millones de dosis por mes, en la forma potencial de viales individuales o multidosis. Como se ha revelado anteriormente, la capacidad de la Compañía de hacer millones de dosis por mes depende de las inversiones en la ampliación y mayor desarrollo de la infraestructura de fabricación existente de la Compañía. Fuente: Moderna






























¿Quieres envíar un comentario?
Comentarios(2):
Vacuna? MEJOR UN MEDICAMENTO QUE LO REMEDIE.Y SIN MUCHAS CONTRAINDICACIONES SI ES POSIBLE .
LA VACUNA A VER A QUIEN SE LA COMPRAN NO PASE COMO CON LOS TEST .POR FAVOR.